湖南省2022年下学期高一期末考试(标识)历史答案
湖南省2022年下学期高一期末考试(标识)历史答案,目前全国100所名校答案网已经汇总了湖南省2022年下学期高一期末考试(标识)历史答案的各科答案和试卷,更多全国100所名校答案请关注本网站。

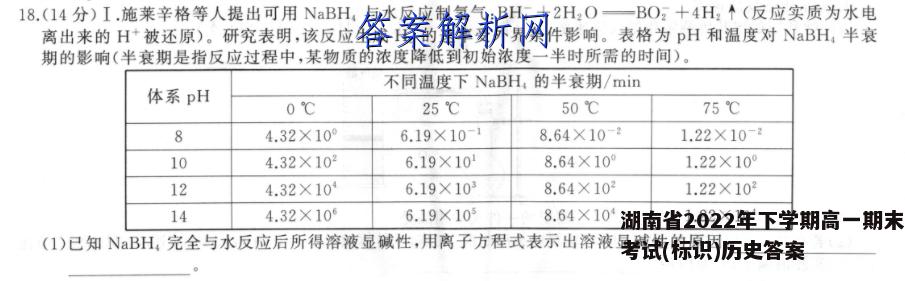
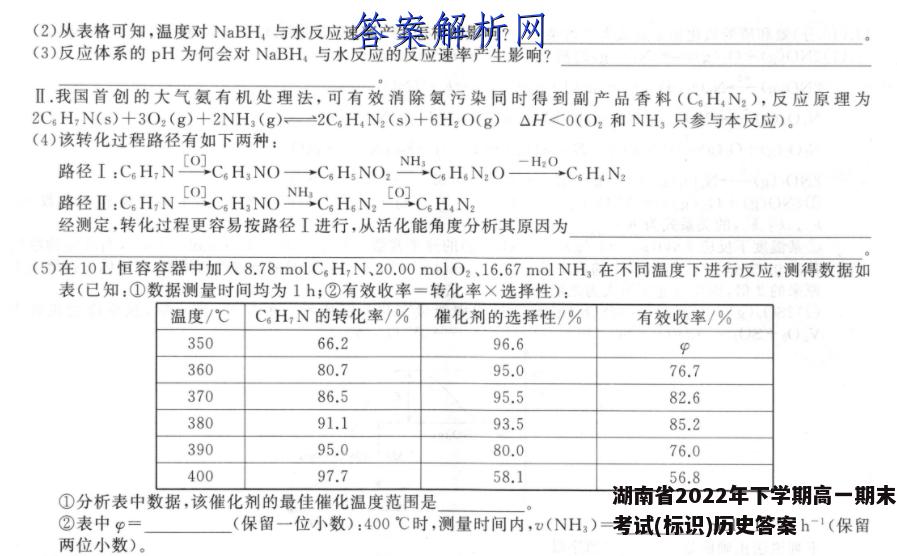

18.(14分)I.施莱辛格等人提出可用NaBH,与水反应制氢气:BH,+2H2O一BO2十4H2个(反应实质为水电离出来的H+被还原)。研究表明,该反应生成H2的速率受外界条件影响。表格为pH和温度对NaBH,半衰期的影响(半衰期是指反应过程中,某物质的浓度降低到初始浓度一半时所需的时间)。不同温度下NaBH,的半衰期/min体系pH0℃25℃50℃75℃84.32×10°6.19×10-18.64×10-21.22×10-2104.32×1026.19×108.64×10°1.22×10°124.32×106.19×1038.64×1021.22×102144.32×106.19×1058.64×101.22×10(I)已知NBH,完全与水反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因:(2)从表格可知,温度对NaBH,与水反应速率产生怎样的影响?(3)反应体系的pH为何会对NaBH,与水反应的反应速率产生影响?Ⅱ.我国首创的大气氨有机处理法,可有效消除氨污染同时得到副产品香料(C6HN2),反应原理为2C6H,N(s)+3O2(g)+2NH(g)一2C6H4N2(s)+6H2O(g)△H<0(O2和NH3只参与本反应).(4)该转化过程路径有如下两种:路径I:C,H,N[OC,H,NO→C,H,NO,NHC,H,N,O一OC,H,N路径Ⅱ:C,H,N[OC,H,NO NH.C,HN,[OC,H,N经测定,转化过程更容易按路径I进行,从活化能角度分析其原因为(5)在10L恒容容器中加入8.78molC6H,N、20.00molO2、16.67 mol NH3在不同温度下进行反应,测得数据如表(已知:①数据测量时间均为1h;②有效收率=转化率×选择性):温度/℃C6H,N的转化率/%催化剂的选择性/%有效收率/%35066.296.6p36080.795.076.737086.595.582.638091.193.585.239095.080.076.040097.758.156.8①分析表中数据,该催化剂的最佳催化温度范围是②表中p=(保留一位小数):400℃时,测量时间内,v(NH3)=mol·L1·h-1(保留两位小数)。【答案】I.(1)BO2+2H2O=H3BO3+OH-(2分)(2)温度越高,反应速率越快(2分)(3)体系碱性越强,水电离产生c(H+)越小,反应速率越小(2分)Ⅱ.(4)路径I时,反应整体上的活化能更低(2分)(5)①370-380℃(2分)②63.9%(2分)0.50(2分)【解析】I.(1)由信息BH:十2H2O一BO2+4H2↑可知,NaBH,完全与水反应,生成NaBO2和H2,BO2发生水解反应,生成HBO3和OH,离子方程式为BO2十2H2O一H3BO3十OH。(2)由表格数据可知,相同pH下,温度越高,NaBH,的半衰期越短,则温度越高,反应速率越快。(3)由题干信息可知,用NBH,与水反应制氢气,实质为水电离出来的H+被还原,而在碱性溶液中,水的电离受到抑制,且溶液的碱性越强,水电离程度越小,水电离产生的c(H+)越小,所以反应速率越慢。Ⅱ.(4)反应的活化能越低,单位体积内活化分子数目越多,有效碰撞机会越大,化学反应速率越快,反应越容易按此路径进行,则转化过程更容易按路径I进行的原因为路径I反应整体上的活化能更低。(5)①由表数据可得,温度低于370℃时,转化率较低,温度高于380℃时,催化剂选择性明显降低,则温度控制在370一380℃为最佳温度。②有效收率=转化率×选择性,则9=66.2%×96.6%≈63.9%;400℃时,参与反应的n(C。H,N)=8.78molX97.7%X58.1%≈5.0mol,则参与反应的n(NH3)=n(CH,N)=5.0mol,v(NH,)=△n5.0 molV△t10LX1h0.50mol·L-1·h-1。

【答案】B【解析】材料体现了坚持一个中国原则,符合和平与发展的时代主题,①符合题意;竞争、合作和冲突是国际关系的基本形式,②错误;材料没有体现政治多极化是不可阻挡的历史潮流,③不符合题意;中国政府和尼加拉瓜政府决定相互承认并恢复大使级外交关系,体现了国家间的共同利益是国家合作的基础,④符合题意。