衡中同卷2022-2023上学期高三期末考试(全国卷)数学答案
衡中同卷2022-2023上学期高三期末考试(全国卷)数学答案,目前全国100所名校答案网已经汇总了衡中同卷2022-2023上学期高三期末考试(全国卷)数学答案的各科答案和试卷,更多全国100所名校答案请关注本网站。

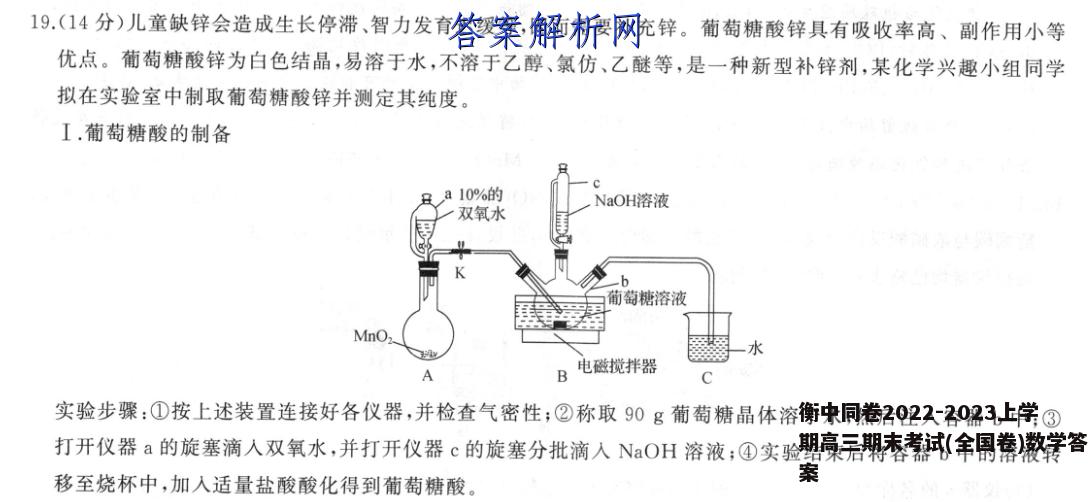


19.(14分)儿童缺锌会造成生长停滞、智力发育迟缓等,因而需要补充锌。葡萄糖酸锌具有吸收率高、副作用小等优点。葡萄糖酸锌为白色结晶,易溶于水,不溶于乙醇、氯仿、乙醚等,是一种新型补锌剂,某化学兴趣小组同学拟在实验室中制取葡萄糖酸锌并测定其纯度。I.葡萄糖酸的制备ga10%的NaOH溶液双氧水葡萄糖溶液MnO,一水&电磁搅拌器实验步骤:①按上述装置连接好各仪器,并检查气密性;②称取90g葡萄糖晶体溶于水,然后注入容器b中:③打开仪器a的旋塞滴入双氧水,并打开仪器c的旋塞分批滴入NaOH溶液;④实验结束后将容器b中的溶液转移至烧杯中,加入适量盐酸酸化得到葡萄糖酸。(1)步骤①进行气密性检查的操作方法是仪器c的名称为;仪器c中上下连通玻璃管的作用是(2)在容器b中发生反应的化学方程式为(3)在制取葡萄糖酸的过程中滴入NaOH溶液的目的是Ⅱ.葡萄糖酸锌的制备实验步骤:①在上述盛有葡萄糖酸的烧杯中加入足量氧化锌,并用玻璃棒不断搅拌;②在90℃水浴中保温20min生成葡萄糖酸锌;③将液体冷却至室温,加10mL95%乙醇,并不断搅拌,烧杯中有胶状葡萄糖酸锌析出,充分搅拌后,用倾析法除去乙醇,在50℃温度下烘干得葡萄糖酸锌粗品。(4)在制取葡萄糖酸锌时,加入95%乙醇的目的是Ⅲ.葡萄糖酸锌纯度的测定测定原理:在pH=10左右的溶液中铬黑T(EBT)与Zn+形成稳定紫红色螯合物(Zn一EBT);滴入乙二胺四乙酸(EDTA)能与Zn+形成更稳定的无色螯合物。滴定至终点时,EBT便被EDTA从Zn一EBT中置换出来,游离的EBT在pH=8~11的溶液中呈纯蓝色。Zn-EBT+EDTA Zn-EDTA+EBT紫红色纯蓝色实验步骤:①称量5.0g粗品加水微热使其溶解,配成250mL溶液;然后移取25.00mL待测液于锥形瓶中滴入氨-氯化铵缓冲液(pH=10.0)与EBT指示剂。②用0.05mol·L1的乙二胺四乙酸(EDTA)滴定,重复操作2~3次,平均消耗EDTA的体积为20.00mL。(5)滴定至终点时的现象为(6)所得粗品葡萄糖酸锌的纯度为(计算结果精确到0.1%)。【答案】I.(1)打开K,将C中导气管末端插入液面以下,用酒精灯微热烧瓶,若C中导气管口有气泡冒出,撤去酒精灯,导气管内产生稳定液柱,说明气密性良好(2分)恒压滴液漏斗(1分)平衡压强,利于液体顺利流下(1分)(2)2CH2 OH(CHOH)CHO+O2+2NaOH-2CH2 OH(CHOH)COONa+2H2O(2)(3)滴入的NOH溶液与生成的葡萄糖酸反应,使平衡向右移动,有利于葡萄糖酸的生成(2分)Ⅱ.(4)降低葡萄糖酸锌的溶解度,利于晶体析出(2分)Ⅲ.(5)滴入最后一滴EDTA,溶液由紫红色变成纯蓝色,且半分钟内不变色(2分)(6)91.0%(2分)【解析】I.(1)检查装置气密性,首先要形成密闭体系,打开K,将C中导气管末端浸入液面以下,然后微热烧瓶观察现象,若加热时导气管末端有气泡冒出,撤去酒精灯后,导气管中产生稳定液柱,说明气密性良好。仪器℃为恒压滴液漏斗,其中上下连通玻璃管起到平衡压强,利于液体顺利流下的作用。(2)葡萄糖被O2氧化成葡萄糖酸,然后葡萄糖酸与NOH溶液反应生成葡萄糖酸钠。(3)在制取葡萄糖酸时,滴入的NOH溶液与葡萄糖酸反应,促使平衡向右移动,有利于葡萄糖酸的生成。Ⅱ.(4)在葡萄糖酸锌的混合液中,滴入95%的乙醇,可以降低其溶解度,利于晶体析出。Ⅲ.(5)在葡萄糖酸锌溶液中滴入EBT试剂,呈紫红色;当滴定到终,点时,溶液恰好变成纯蓝色,且半分钟内不变色。(6)根据滴定原理,可知m[Zn(C6H0,)2]=0.05mol·L-1×20.00mL×10-3L·mL-1×10×455g·mol-1=4.55g,粗品的纯度为.55g×100%=91.0%。5.0g
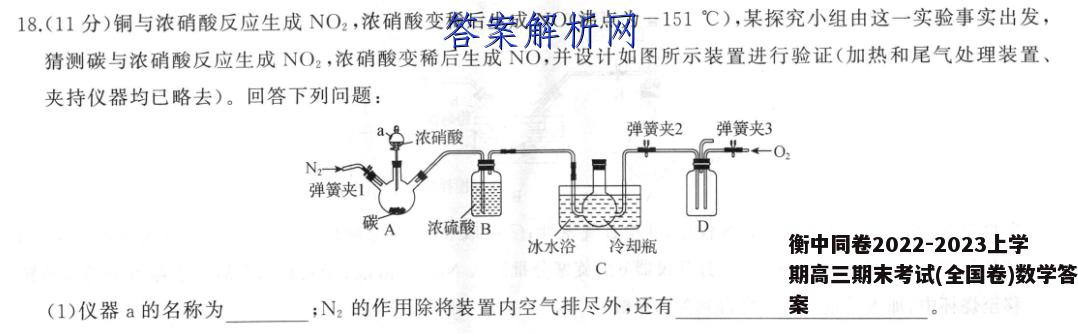
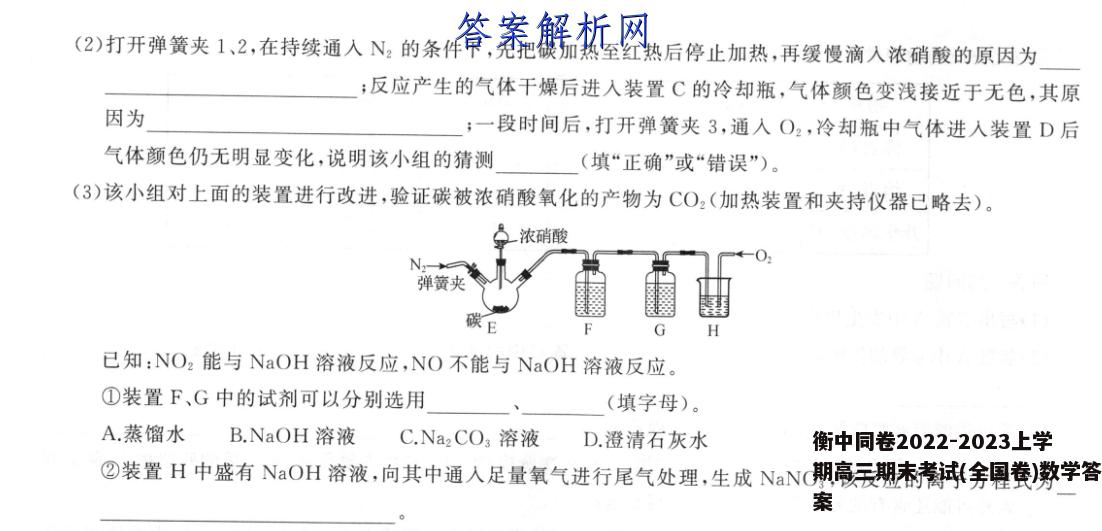

18.(11分)铜与浓硝酸反应生成NO2,浓硝酸变稀后生成NO(沸点为一151℃),某探究小组由这一实验事实出发,猜测碳与浓硝酸反应生成NO2,浓硝酸变稀后生成NO,并设计如图所示装置进行验证(加热和尾气处理装置、夹持仪器均已略去)。回答下列问题:一浓硝酸弹簧夹2弹簧夹3N弹簧夹1碳A浓硫酸B冰水浴冷却瓶C(1)仪器a的名称为;N2的作用除将装置内空气排尽外,还有(2)打开弹簧夹1、2,在持续通入N2的条件下,先把碳加热至红热后停止加热,再缓慢滴入浓硝酸的原因为;反应产生的气体干燥后进入装置C的冷却瓶,气体颜色变浅接近于无色,其原因为;一段时间后,打开弹簧夹3,通入O2,冷却瓶中气体进入装置D后气体颜色仍无明显变化,说明该小组的猜测(填“正确”或“错误”)。(3)该小组对上面的装置进行改进,验证碳被浓硝酸氧化的产物为CO2(加热装置和夹持仪器已略去)。浓硝酸弹簧夹已知:NO2能与NaOH溶液反应,NO不能与NaOH溶液反应。①装置F、G中的试剂可以分别选用(填字母)。A.蒸馏水B.NaOH溶液C.Na2CO3溶液D.澄清石灰水②装置H中盛有NaOH溶液,向其中通入足量氧气进行尾气处理,生成NaNO3,该反应的离子方程式为【答案】(1)分液漏斗(1分)将气体产物吹入后续装置中(1分)(2)浓硝酸受热分解,无法确保浓硝酸与碳反应(2分)红棕色NO2在冰水浴条件下转化为无色的N2O,(2分)错误(1分)(3)①A(1分)D(1分)②4NO+3O2+4OH-=4NO+2H2O(2分)【解析】(1)根据仪器构造可知,仪器的名称为分液漏斗;由于本实验需验证有无NO产生,空气中的O2能氧化NO,所以用N2先将装置内的空气排尽,并将气体产物吹入后续装置中。(2)浓硝酸受热时分解,浓度减小,无法确保加入的浓硝酸与碳反应,所以先将碳加热至红热,再缓慢滴入浓硝酸;气体颜色变浅是因为NO2转化为N2O4的反应为放热反应,在冰水浴条件下大部分红棕色的NO2转化为无色的N2O4,使气体颜色变浅并接近于无色;若猜测正确,NO遇O2会生成红棕色NO2,D装置中气体颜色应该有明显变化,从颜色无明显变化可推知该猜测是错误的。(3)①Ca(OH)2微溶,澄清石灰水中Ca(OH)2的量很少,装置F中可盛有蒸馏水,将NO2转化为NO,防止NO2与水反应生成HNO3对CO2的检验造成千扰,G中的试剂为检验CO2的澄清石灰水。②NaOH、NO与O2反应生成NaNO3,利用化合价升降法进行氧化还原反应方程式的配平,离子方程式为4NO+302+40H--4NO3+2H2O.