海淀八模2023届高三模拟测试卷(一)1化学答案
海淀八模2023届高三模拟测试卷(一)1化学答案,目前全国100所名校答案网已经汇总了海淀八模2023届高三模拟测试卷(一)1化学答案的各科答案和试卷,更多全国100所名校答案请关注本网站。

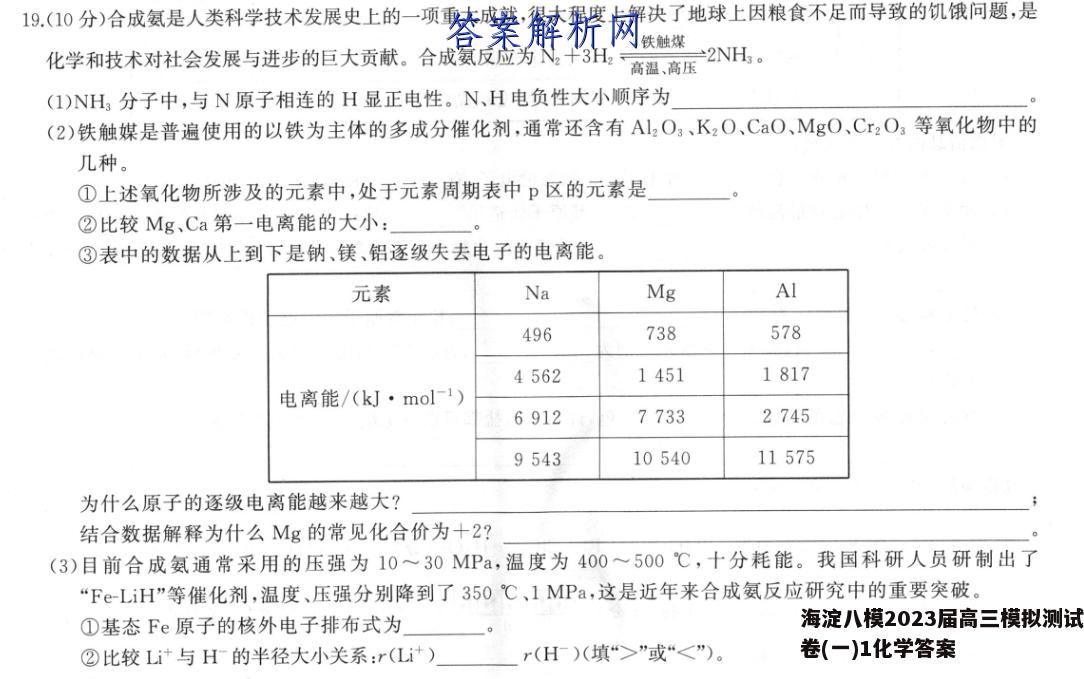

19.(10分)合成氨是人类科学技术发展史上的一项重大成就,很大程度上解决了地球上因粮食不足而导致的饥饿问题,是铁触煤化学和技术对社会发展与进步的巨大贡献。合成氨反应为N十3H高温,离压NH。(1)NH3分子中,与N原子相连的H显正电性。N、H电负性大小顺序为(2)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有Al2O3、KzO、CaO、MgO、Cr2O3等氧化物中的几种。①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是②比较Mg、Ca第一电离能的大小:③表中的数据从上到下是钠、镁、铝逐级失去电子的电离能。元素NaMgAl496738578456214511817电离能/(kJ·mol-1)69127733274595431054011575为什么原子的逐级电离能越来越大?结合数据解释为什么Mg的常见化合价为+2?(3)目前合成氨通常采用的压强为10~30MPa,温度为400~500℃,十分耗能。我国科研人员研制出了“Fe-LiH”等催化剂,温度、压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。①基态Fe原子的核外电子排布式为②比较Li与H的半径大小关系:r(Li计)r(H)(填“>”或“<”)。【答案】(1)N>H(1分)(2)①Al、O(1分)②Mg>C(2分)③随着电子的逐个失去,阳离子所带的正电荷数越来越多,再失去1个电子需要克服的电性吸引力越来越大,消耗的能量也越来越多(2分)镁原子的最外层的电子数为2,故I,、I2相差不大,而I2、【3相差很大,所以镁容易失去两个电子形成带2个单位正电荷的阳离子,镁元素的常见化合价为十2(2分)(3)①1s22s22p3s23p3d4s2或[Ar]3d4s2(1分)②<(1分)【解析】(1)NH3分子中,与N原子相连的H显正电性,说明N的电负性大于H,即电负性N>H。(2)①位于P区的元素在周期表中位于ⅢA族至MA族、0族,所以题给氧化物所涉及的元素中,处于元素周期表中p区的元素是Al、O。②同一主族元素,从上到下,第一电离能逐渐减小,镁和钙位于同一主族,且钙的核电荷数大于镁,所以镁的第一电离能大于钙的第一电离能。③根据表格数据可知,同一种元素的逐级电离能逐渐增大,这是因为随着电子的逐个失去,阳离子所带的正电荷数越来越多,再失去1个电子需要克服的电性吸引力越来越大,消耗的能量也越来越多;镁原子的最外层的电子数为2,故I1、I2相差不大,而I2、I3相差很大,所以镁容易失去两个电子形成带2个单位正电荷的阳离子,镁元素的化合价为十2。(3)①铁原子的核电荷数为26,核外电子排布式为1s22s22p3s23p3d4s2或[Ar]3d4s2。②锂原子的核电荷数为3,锂离子核外电子数为2;氢原子的核电荷数为1,H的核外电子数2,核外电子排布相同的离子,核电荷数越大,离子半径越小,故r(Li)



18.(10分)X、Y、Z、W、Q、R均为元素周期表前四周期元素,原子序数依次增大,其相关信息如下:X元素的基态原子中,电子分布在三个不同的能级,且每个能级的电子总数相等Y原子的2p轨道有3个未成对电子Z元素的族序数是其周期数的3倍W原子的第一至第六电离能:I1=578kJ·mol1,I2=1817kJ·mol-1,I3=2745kJ·mol1,14=11575kJ·mol-1,Is=14830kJ·mol-1,6=18376kJ·mol-1Q为前四周期中电负性最小的元素R元素位于元素周期表的第11列请回答下列问题:(1)元素X、Y、Z中,电负性由大到小的顺序为(填元素符号,下同),第一电离能最大的为(2)基态W原子的价电子排布图为,基态Q原子核外电子占据最高能级的电子云轮廓图为形。(3)R在元素周期表中的位置是,属于区,基态R原子的电子排布式为【解析】X、Y、Z、W、Q、R均为元素周期表前四周期元素,且原子序数依次增大。X元素的基态原子中,电子分布在三个不同的能级,且每个能级的电子总数相等,则X原子的核外电子排布式为1s22s22p,则X为碳元素;Y原子的2p轨道有3个未成对电子,原子的核外电子排布式为1s22s22p,则Y为氨元素;Z元素的族序数是其周期数的3倍,Z处于第二周期,最外层电子数为6,则Z为氧元素;Q为前四周期中电负性最小的元素,即前四周期金属性最强的元素,为钾元素;W原子的第四电离能剧增,表现十3价,原子序数大于氧元素、小于钾元素,则W为铝元素;元素R位于周期表中第11列,R处于第四周期,为铜元素。(1)同周期主族元素随原子序数增大电负性增大,所以电负性O>N>C;同周期元素从左至右第一电离能呈增大趋势,但N的2p能级有3个电子,处于半满稳定状态,第一电离能比O的大,所以第一电离能N>O>C。3s3p(2)W为13号A1元素,其核外电子排布式为1s22s22p3s23p,所以其价电子排布图为个V:Q为K元素,基态K原子的电子排布式为1s22s22p3s23p4s',核外占据最高能级为4s,s轨道为球形,因而占据最高能级的电子云轮廓图为球形。(3)元素R为铜元素,在元素周期表中的位置为第四周期B族,属于ds区元素,基态Cu原子的电子排布式为1s22s22p3s23p3d4s或[Ar]3d4s。