[合肥一模]合肥市2023年高三第一次教学质量检测生物答案
[合肥一模]合肥市2023年高三第一次教学质量检测生物答案,目前全国100所名校答案网已经汇总了[合肥一模]合肥市2023年高三第一次教学质量检测生物答案的各科答案和试卷,更多全国100所名校答案请关注本网站。

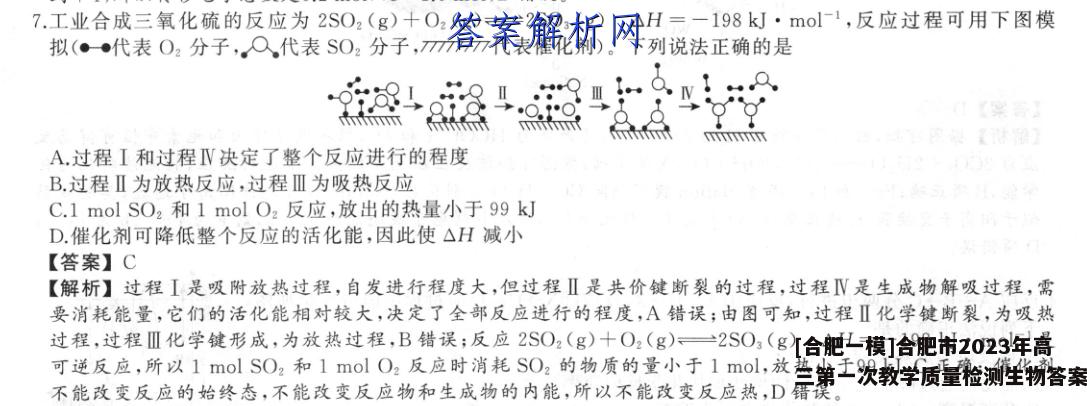
7.工业合成三氧化硫的反应为2SO2(g)+O2(g)一2SO3(g)△H=一198kJ·mol-1,反应过程可用下图模拟(●●代表O2分子,Q代表SO2分子,77777代表催化剂)。下列说法正确的是TA.过程I和过程V决定了整个反应进行的程度B.过程Ⅱ为放热反应,过程Ⅲ为吸热反应C.1 mol SO2和1molO2反应,放出的热量小于99kJD.催化剂可降低整个反应的活化能,因此使△H减小【答案】C【解析】过程I是吸附放热过程,自发进行程度大,但过程Ⅱ是共价键断裂的过程,过程Ⅳ是生成物解吸过程,需要消耗能量,它们的活化能相对较大,决定了全部反应进行的程度,A错误;由图可知,过程Ⅱ化学键断裂,为吸热过程,过程Ⅲ化学键形成,为放热过程,B错误;反应2SO2(g)十O2(g)一2SO3(g)△H=-198kJ·mol-1是可逆反应,所以1 mol SO2和1molO2反应时消耗S02的物质的量小于1mol,放热小于99kJ,C正确;催化剂不能改变反应的始终态,不能改变反应物和生成物的内能,所以不能改变反应热,D错误。

6.用CH4催化还原NO2可以消除氮氧化物的污染,例如:①CH(g)+4NO2(g)4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-②CH(g)+4NO(g)-2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol-1下列说法错误的是A.由反应①可知CH4(g)+4NO2(g)一4NO(g)+CO2(g)+2H2O(1)△H<-574kJ·mo1-1B.反应①②转移的电子数相同C.若用标准状况下4.48LCH4还原NO2至N2,放出的热量为173.4kJD.若用标准状况下4.48LCH还原NO2至N2,整个过程中转移的电子的总物质的量为0.8mol【答案】D【解析】根据反应①可知,当生成液态水时,由于气体转化为液体时放热,所以生成液态水放出的热量更多,放热越多,焓变越小,A正确;物质的量相等的甲烷分别参加反应①和②,C元素的化合价均是从一4升高到十4,所以转移电子数相同,B正确;标准状况下4.48L甲烷的物质的量是0.2mol,还原NO2至N2,放出的热量为574+1160kJ·mol-1×0.2mol=173.4kJ,C正确;0.2mol甲烷还原NO2至N2,C元素的化合价从一4升高2到十4,所以转移电子总数是0.2molX8=1.6mol,D错误。