山东省滨州市2022-2023学年高二上学期期末考试(2023.02)生物答案
山东省滨州市2022-2023学年高二上学期期末考试(2023.02)生物答案,目前全国100所名校答案网已经汇总了山东省滨州市2022-2023学年高二上学期期末考试(2023.02)生物答案的各科答案和试卷,更多全国100所名校答案请关注本网站。


1.糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是A.脱氧过程是吸热反应,可降低温度,延长糕点保质期B.脱氧过程中铁作原电池正极,电极反应为Fe一3e一Fe3+C.脱氧过程中碳作原电池负极,电极反应为2H2O+O2十4e一4OHD.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气0.015mol【答案】D【解析】脱氧过程是放热反应,可吸收氧气,延长糕点保质期,A项错误;脱氧过程中铁作原电池负极,电极反应为Fe一2e—Fe2+,B项错误;脱氧过程中碳作原电池正极,电极反应为2H2O+O2十4e一4OH-,C项错误;含有1.12g铁粉的脱氧剂,铁的物质的量为0.02mol,其最终被氧化为氢氧化铁,电子转移的物质的量为0.06mol,理论上最多能吸收氧气0.015mol,D正确。
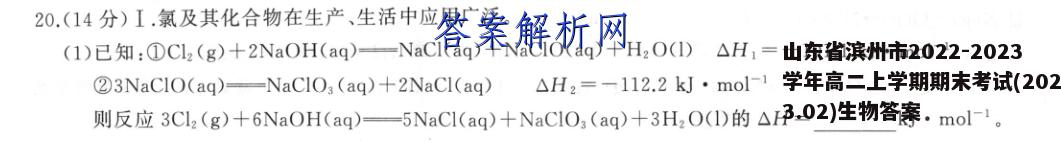


20.(14分)I.氯及其化合物在生产、生活中应用广泛。(1)已知:①Cl2(g)+2NaOH(aq)-NaCl(aq)+NaC1O(aq)+H2O(I)△H,=-101.1kJ·mol-123NaClO(aq)=NaClO3 (aq)+2NaCl(aq)△H2=-112.2kJ·mol-1则反应3Cl2(g)+6NaOH(aq)一5NaCl(aq)+NaClO,(aq)+3H2O(1)的△H=kJ·mol-1。(2)几种含氯离子的相对能量如表所示:离子Cl(aq)CIO (aq)ClO2 (ag)C1O3 (aq)C1O,(aq)相对能量/(kJ·mol-1)0601016338①在上述五种离子中,最稳定的离子是(填离子符号,下同),最不稳定的离子是②写出C1O3反应生成CIO4和CI-的热化学方程式:(3)以HCI为原料,用O2氧化制取C2,可提高效益,减少污染。反应HCI (g)H,0(g)如下:200℃CuO/CuCl2过程I(氯化)4HCI(g)+O2 (g)2Cl2(g)+2H2O(g)△HCuo (s)CuCl2(s)过程Ⅱ(氧化-115.4kJ·mol-400℃上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可C2(g)02(g)使HC1转化率接近100%。其基本原理如图所示:已知过程I的反应为2HCl(g)+CuO(s)CuCl2(s)+H2O(g)△H,=-120.4kJ·mol-1①过程Ⅱ反应的热化学方程式为②过程I流出的气体通过稀NaOH溶液(含少量酚酞)进行检测,氯化初期主要为不含HCI的气体,判断氯化结束时溶液的现象为Ⅱ.100mL0.200mol·L1CuS0,溶液与1.95g锌粉在量热计中充分反应。测得反应前温度为20.1℃,反应后最高温度为30.1℃。已知:反应前后,溶液的比热容均近似为4.18J·g1·℃-1、溶液的密度均近似为1.00g·cm-3,忽略溶液体积、质量变化和金属吸收的热量。回答下列问题:(4)反应放出的热量Q=kJ。(5)反应Zn(s)+CuSO,(aq)-ZnSO,(aq)+Cu(s)的△H=kJ·mol1(列式计算)。【答案】I.(1)-415.5(2分)(2)①C1-(aq)(1分)ClO2(aq)(1分)②4Cl03(aq)=3C1O(aq)+C1-(aq)△H=-138kJ·mol-1(2分)(3)①2CuCl2(s)+O2(g)—2CuO(s)+2Cl2(g)△H2=+125.4kJ·mol-1(2分)②溶液由红色变为无色(或溶液红色变浅)(2分)Ⅱ.(4)4.18(2分)(5)4.18kJ·mol-1=-209(2分)0.100×0.200【解析】I.(1)分析题给热化学方程式,根据盖斯定律,由①×3+②可得3Cl2(g)+6NaOH(aq)一5NaCl(aq)+NaCIO3(aq)+3H2O(1),则有△H=3△H1+△H2=(-101.1kJ·mol-1)×3+(-112.2kJ·mol-1)=-415.5kJ·mol-1。(2)①物质具有的能量越高,其稳定性越弱,故最稳定的离子是Cl(aq),最不稳定的离子是ClO2(aq)。②由CIO3生成ClO和C1-的反应为4ClO3(aq)一3ClO(aq)+C1(aq),该反应的△H=3×38kJ·mol-1-4×63kJ·mol-1=-138kJ·mol-1。(3)①由图可知,过程Ⅱ(氧化)发生的反应为2CuCl2(s)十O2(g)一=2CuO(s)+2Cl2(g),其△H记为△H2。将题给O2氧化HC1的热化学方程式编号为ⅰ,将过程I反应的热化学方程式编号为ⅱ,根据盖斯定律,由i-i×2可得2CuCl2(s)+O2(g)一2Cu0(s)+2Cl2(g),则有△H2=(-115.4kJ·mol-1)(-120.4kJ·mol-1)×2=+125.4kJ·mol-1.②氯化初期主要为不含HCl的气体,则初期溶液呈红色,氯化结束时,HCl与NaOH溶液发生中和反应,溶液褪色。Ⅱ.(4)根据Q=cm△t,反应放出的热量Q=4.18J·g1·℃-1×100mL×1.00g·cm-3×(30.1℃-20.1℃)=4.18×103J=4.18kJ。1.95g(5)n(CuS04)=0.1LX0.200mol·L-1=0.02mol,n(Zn)=65g·mol7=0.03mol,显然Zn过量,即0.02 mol Zn2和0.02 mol CuSO,反应放出的热量为4.18kJ,故反应Zn(s)+CuS0,(aq)一ZnSO,(aq)+Cu(s)4.18kJ的△H=一=-209kJ·mol-1。0.02 mol