[咸阳一模]陕西省咸阳市2023年高考模拟检测(一)1生物答案
[咸阳一模]陕西省咸阳市2023年高考模拟检测(一)1生物答案,目前全国100所名校答案网已经汇总了[咸阳一模]陕西省咸阳市2023年高考模拟检测(一)1生物答案的各科答案和试卷,更多全国100所名校答案请关注本网站。


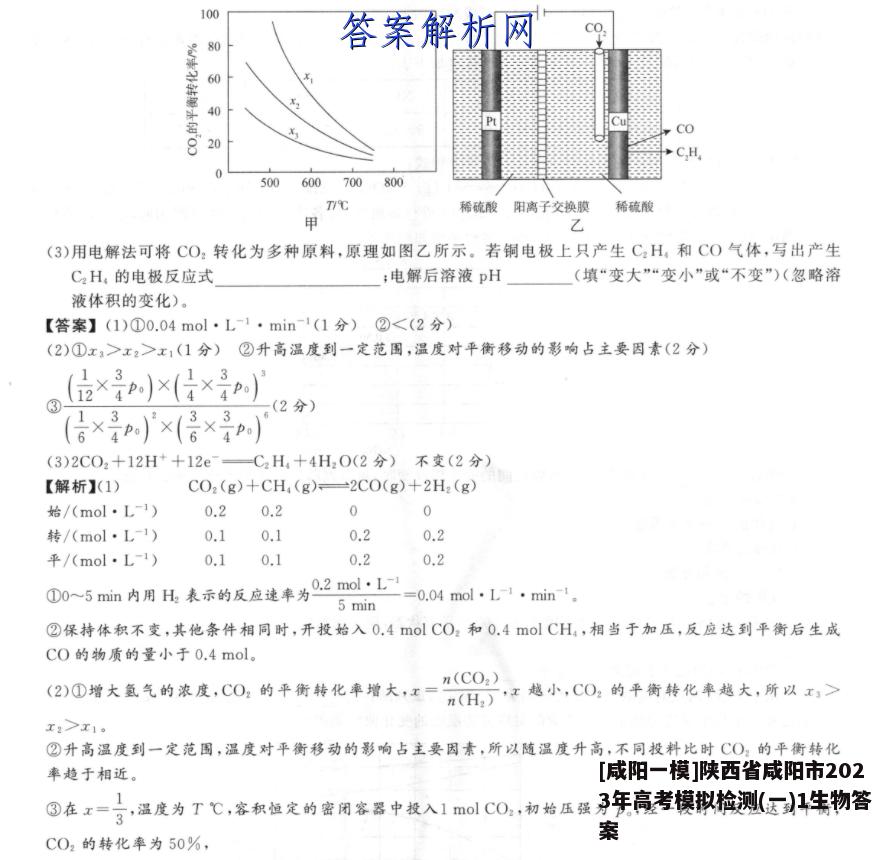

19.(12分)为了实现“碳中和”,研发二氧化碳的利用技术成为热点。(1)用二氧化碳与甲烷反应可以制工业合成气(CO、H2)。T℃,在1L的密闭容器中分别投入0.2 mol CO2和0.2 mol CH4,发生反应CO2(g)+CH(g)一2CO(g)十2H2(g),经5min达到平衡,测得生成0.2molCO,则:①0~5min内用H2表示的反应速率为②保持体积不变,其他条件相同时,开始投入0.4 mol CO2和0.4 mol CH4,反应达到平衡后生成C0的物质的量(填“>”“<”或“=”)0.4mol。(2)用二氧化碳与氢气催化加氢制乙醇,其反应原理为2CO2(g)+6H2(g)CH,CH2OH(g)十3H2O(g)△H<0。经实验测定在不同投料比x1、x2、x3时CO2的平衡转化率与温度的关系如图甲所①x1、x2、x3由大到小的顺序为②从平衡角度分析,随温度升高,不同投料比时CO2的平衡转化率趋于相近的原因是③在x=3,温度为T℃,容积恒定的密闭容器中投人1mlC0,初始压强为p。,经一段时间反应达到平衡,CO2的转化率为50%,列式表示该反应的压强平衡常数K。=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。100CO806040CO20→C,H500600700800T/℃稀硫酸阳离子交换膜稀硫酸甲乙(3)用电解法可将CO2转化为多种原料,原理如图乙所示。若铜电极上只产生C2H,和CO气体,写出产生C2H,的电极反应式;电解后溶液pH(填“变大”“变小”或“不变”)(忽略溶液体积的变化)。【答案】(1)①0.04mol·L1·min-1(1分)②<(2分)(2)①x>x2>x1(1分)②升高温度到一定范围,温度对平衡移动的影响占主要因素(2分)(位×)×(×】(2分)(信×)'×(倍×p)(3)2C02+12H++12eC2H+4H20(2分)不变(2分)【解析】(1)CO2(g)+CH (g)=2CO(g)+2H2 (g)始/(mol·L1)0.20.200转/(mol·L-1)0.10.10.20.2平/(mol·L-1)0.10.10.20.2①0~5min内用H2表示的反应速率为.2molL=0.04molL1·min1。5 min②保持体积不变,其他条件相同时,开投始入0.4 mol CO2和0.4 mol CH4,相当于加压,反应达到平衡后生成C0的物质的量小于0.4mol。(2》0增大氨气的浓度,C0,的平街转化率增大,江=z总小,C0,的平衡转化率越大,所以,>≥n(CO2)x2>x1。②升高温度到一定范围,温度对平衡移动的影响占主要因素,所以随温度升高,不同投料比时CO2的平衡转化率趋于相近。③在x=,温度为T℃,容积恒定的密闭容器中投入1olCO2,初始压强为p。,经一段时间反应达到平衡,3C02的转化率为50%,2CO2(g)+6H2 (g)=CH CH2 OH(g)+3H2 O(g)始/mol1300转/mol0.51.50.250.75平/mol0.51.50.250.753平衡后总压强为力,X,该反应的压强平衡常数K,=25×px是×(×p×)(s×px)'×(告×p×)(2×p)×(行×p)(后×p)'×(后×p)(3)根据图示,CO2在铜电极得电子生成C2H,,电极反应式为2CO2+12H+12e一C2H,十4H2O;总反应为2C0,十2H,0色解C,H,十30,2C0,也2C0+0,电解后硫酸的物质的量不变,溶液pH不变。
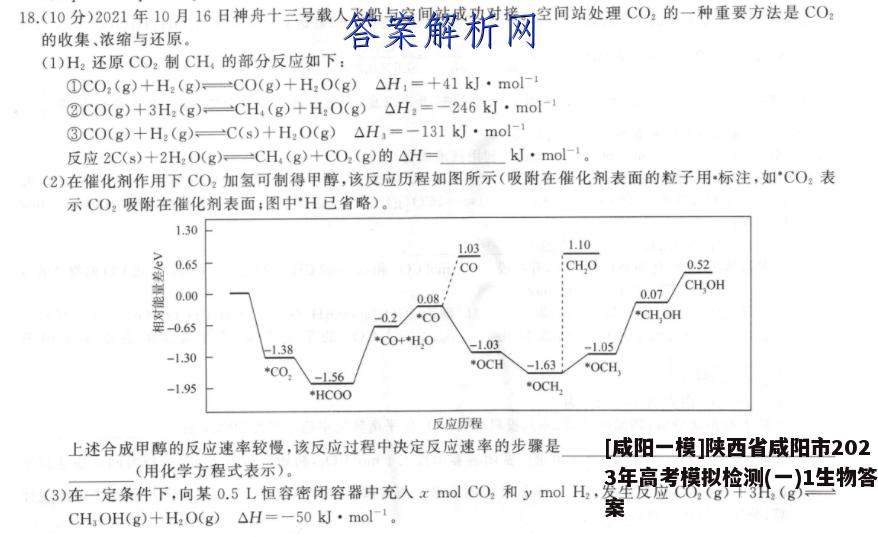
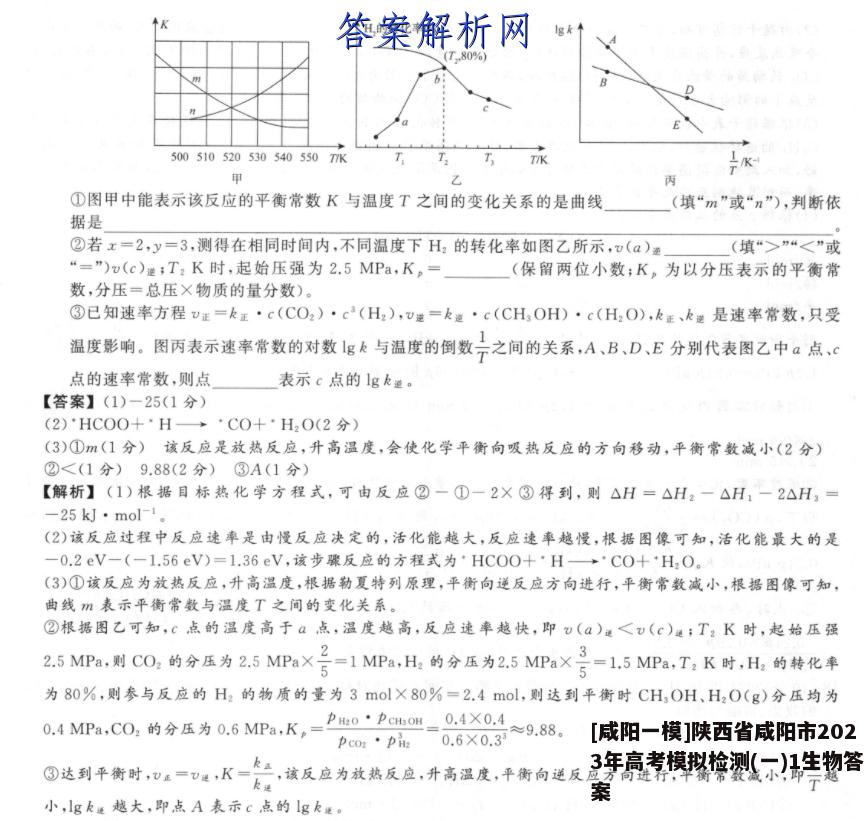
18.(10分)2021年10月16日神舟十三号载人飞船与空间站成功对接。空间站处理C02的一种重要方法是CO2的收集、浓缩与还原。(1)H2还原CO2制CH的部分反应如下:①CO2(g)+H2(g)CO(g)+H2O(g)△H,=+41kJ·mol-②CO(g)+3H2(g)=CH(g)+H2O(g)△H2=-246kJ·mol-③C0(g)+H2(g)C(s)+H2O(g)△H.=-131kJ·mo-反应2C(s)+2H2O(g)一CH(g)+CO2(g)的△H=kJ·mol-l(2)在催化剂作用下CO2加氢可制得甲醇,该反应历程如图所示(吸附在催化剂表面的粒子用·标注,如°CO2表示CO2吸附在催化剂表面:图中H已省略)。1.301.031.100.65cOCH.O0.52CH,OH0.000.080.07-0.2*C0*CH,OH*C0+*H,0-1.03-1.05-1.301.38*C0*OCH-1.63*OCH-1.56-1.95*HCOO*OCH,反应历程上述合成甲醇的反应速率较慢,该反应过程中决定反应速率的步骤是(用化学方程式表示)。(3)在一定条件下,向某0.5L恒容密闭容器中充入x mol CO2和y mol H2,发生反应CO2(g)十3H2(g)一CH3OH(g)+H2O(g)△H=-50kJ·mol1.个H,的转化率%(T80%)500510520530540550T/KT/K甲丙①图甲中能表示该反应的平衡常数K与温度T之间的变化关系的是曲线(填“m”或“n”),判断依据是0②若x=2,y=3,测得在相同时间内,不同温度下H2的转化率如图乙所示,v(a)(填“>”“<”或“=”)u(c)避;T2K时,起始压强为2.5MPa,K。=(保留两位小数;K。为以分压表示的平衡常数,分压=总压×物质的量分数)。③已知速率方程v正=k正·c(CO2)·c3(H2),v還=k道·c(CH,OH)·c(H2O),k正、k逆是速率常数,只受温度影响。图丙表示速率常数的对数lgk与温度的倒数于之间的关系,A、B、D、E分别代表图乙中a点、c点的速率常数,则点表示c点的lgk递。【答案】(1)-25(1分)(2)·HCOO+·H→·CO+·H2O(2分)(3)①m(1分)该反应是放热反应,升高温度,会使化学平衡向吸热反应的方向移动,平衡常数减小(2分)②<(1分)9.88(2分)③A(1分)【解析】(1)根据目标热化学方程式,可由反应②一①一2X③得到,则△H=△H2一△H:一2△H,=-25kJ·mol-1.(2)该反应过程中反应速率是由慢反应决定的,活化能越大,反应速率越慢,根据图像可知,活化能最大的是-0.2eV-(-1.56eV)=1.36eV,该步骤反应的方程式为·HC0O+·H→·CO+·H2O。(3)①该反应为放热反应,升高温度,根据勒夏特列原理,平衡向逆反应方向进行,平衡常数减小,根据图像可知,曲线m表示平衡常数与温度T之间的变化关系。②根据图乙可知,c点的温度高于a点,温度越高,反应速率越快,即v(a)远