天壹名校联盟2023年下学期高二期末(1月)地理答案
天壹名校联盟2023年下学期高二期末(1月)地理答案,目前全国100所名校答案网已经汇总了天壹名校联盟2023年下学期高二期末(1月)地理答案的各科答案和试卷,更多全国100所名校答案请关注本网站。

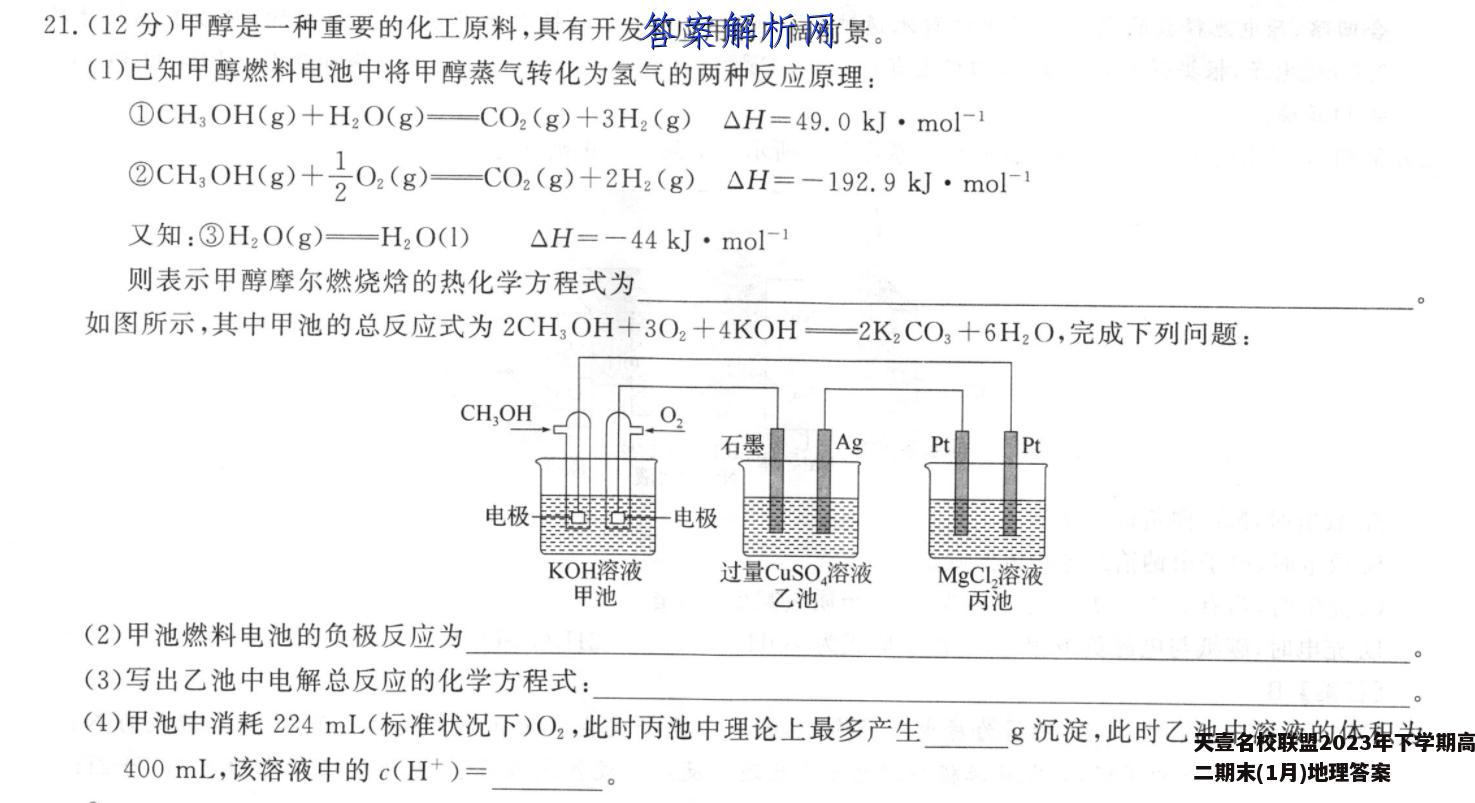


21.(12分)甲醇是一种重要的化工原料,具有开发和应用的广阔前景。(1)已知甲醇燃料电池中将甲醇蒸气转化为氢气的两种反应原理:①CH3OH(g)+H2O(g)-CO2(g)+3H2(g)△H=49.0kJ·mol-②CH,0H(g)+20,(g)C0,(g)+2H,(g)△H=-192.9k·mo1又知:③H2O(g)—H2O(1)△H=-44kJ·mol-1则表示甲醇摩尔燃烧焓的热化学方程式为如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH一2K2CO3+6H2O,完成下列问题:CH,OH石墨AgPt电极电极KOH溶液过量CuSO,溶液MgCL,溶液甲池乙池丙池(2)甲池燃料电池的负极反应为(3)写出乙池中电解总反应的化学方程式:(4)甲池中消耗224mL(标准状况下)O2,此时丙池中理论上最多产生g沉淀,此时乙池中溶液的体积为400mL,该溶液中的c(H+)=(5)若以该甲醇燃料电池为电源,用石墨作电极电解200L含有如下离子的溶液。离子Cu2+H+CISO-c/(mol·L-1)0.5220.5电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),电路中转移的电子的物质的量是mol。【答案】(1)CH,0H(g)+0,(g)C0,(g)+2H,0D△H=-764.7W·mol(2)CH,OH-6e-+80H--CO+6H2O(3)2CuS0,+2H,0电解2Cu十2H,S0,+0,+(4)1.160.1mol·L-1(5)0.8【解析】(1)根据盖斯定律可知,②×3一①X2十③X2即得到表示甲醇摩尔燃烧焓的热化学方程式CH,OH(g)+0,(g)C0,(g)+2H,0)△H=-764.7kJ·mol-1。(2)甲池燃料电池中通入甲醇的电极是负极,则负极反应为CH3OH一6e十8OHCO号十6H2O。(3)乙池是电解池,石墨电极和电源正极相连,氢氧根离子在阳极放电,银电极是阴极,铜离子放电,则电解总反应的化学方程式为2CuS0,十2H,0电解2Cu+2H,S0,+0,+。应的化学方程式为2CuS0,十2H,0电解2Cu+2H,S0,+0,+。(4)甲池中消耗224mL(标准状况下)O2,氧气的物质的量是0.01mol,转移0.04mol电子,丙中得到的沉淀是氢氧化镁,根据得失电子守恒可知形成0.02ol氢氧化镁,则此时丙池中理论上最多产生沉淀的质量是0.02mol×58g·mol1=1.16g,产生氢离子0.04m0l,因此该溶液中的c(H+)=0.04m0l=0.1m0l·L。0.4L(5)溶液中n(Cu2+)=0.2L×0.5mol·L-1=0.1mol,n(H+)=0.2L×2mol·L-1=0.4mol,n(C1-)=0.2LX2mol·L-1=0.4mol,开始阶段,阴极电极反应为Cu2+十2eCu,阳极电极反应为2Cl-一2eC12个,电解一段时间后,两极收集到相同体积(相同条件)的气体,则阴极还发生反应2H+十2一H2个,阳极还发生反应4OH一4e一2HO十O2个,阳极生成氯气0.2mol,假设生成的氧气为xmol,则阴极生成的氢气为(x十0.2)mol,根据得失电子守恒,则0.1mol×2+(x十0.2)molX2=0.2molX2+xmol×4,解得x=0.1,故电路中转移的电子的物质的量是0.1mol×2十(0.1十0.2)mol×2=0.8mol。
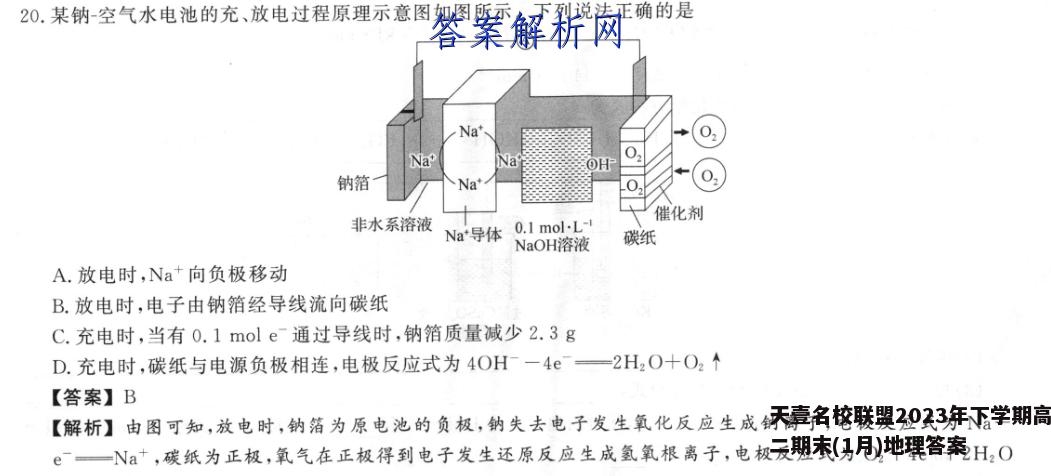

20.某钠-空气水电池的充、放电过程原理示意图如图所示。下列说法正确的是Na'0NaOH年钠箔Na"0催化剂非水系溶液Na*导体0.1 mol.L-!NaOH溶液碳纸A.放电时,Na+向负极移动B.放电时,电子由钠箔经导线流向碳纸C.充电时,当有0.1mole通过导线时,钠箔质量减少2.3gD.充电时,碳纸与电源负极相连,电极反应式为4OH一4e—2H2O十O2↑【答案】B【解析】由图可知,放电时,钠箔为原电池的负极,钠失去电子发生氧化反应生成钠离子,电极反应式为N一e一Na+,碳纸为正极,氧气在正极得到电子发生还原反应生成氢氧根离子,电极反应式为O2十4e十2H2O一4OH;充电时,钠箔与电源负极相连,作电解池的阴极,碳纸与电源正极相连,作电解池的阳极。放电时,阳离子向原电池的正极移动,则钠离子向正极移动,故A错误;放电时,电子由负极经导线流向正极,由分析可知,钠箔为原电池的负极,碳纸为正极,则放电时,电子由钠箔经导线流向碳纸,故B正确;由分析可知,充电时,钠箔与电源负极相连,作电解池的阴极,电极反应式为Na+十e一Na,则当有0.1mol电子通过导线时,钠箔质量增加2.3g,故C错误;由分析可知,充电时,碳纸与电源正极相连,作电解池的阳极,故D错误。*用间接电化学法对大气污染物NO进行无害化处理,其原理如图所示,质子膜允许H+和H2O通过。下列有关说法正确的是S,ON质子膜PbPb电极I电极Ⅱ塔Na,SO,溶液电解池NO-HSOA.电极I为电解池的阳极,吸收塔内发生的反应为2NO+2S2O+2H2O一N2+4HSOB.电解池中的质子运动方向:左室→质子膜→右室C.吸收塔中每处理1 mol NO,右室会生成11.2LO2D.电极Ⅱ发生的反应为4OH-一4e—O2个十2H2O【答案】D【解析】HSO3在电极I上转化为S2O,过程中S的化合价降低,得到电子发生还原反应,则电极I为阴极,电极反应为2HSO5+2e+2H+-S2O-十2H2O,电极Ⅱ为阳极,电极反应为4OH一4e—O2个+2H2O,电解池中阳离子向阴极移动,则电解池中H+通过质子膜向电极I处移动,处理NO时,产生的HSO进入电解池,O2逸出电解池,S2O足流出电解池,向吸收塔中通入NO和S2O发生离子反应,生成N2和HSO,所以吸收塔中发生反应的方程式为2NO+2S2O?+2H2O一N2+4HSO。电极I中HSO5→S2O为还原反应,电极I为电解池的阴极,故A错误;电极I是阴极,电极Ⅱ是阳极,电解池中阳离子向阴极移动,所以质子的移动方向是右室→质子膜→左室,故B错误;吸收塔中每处理1 mol NO,转移电子的物质的量为2mol,则生成0.5molO2,标准状况下为11.2L,但选项没有注明温度和压强,故C错误;电极Ⅱ是阳极,水电离出的氢氧根离子被氧化生成氧气,发生的反应为4OH一4e一O2个+2H2O,故D正确。